服务中心
CUSTOMER SERVICE
产志贺毒素的大肠杆菌(STEC)的威胁:STEC是导致严重食源性感染的主要病原体之一,其常见的血清型包括大肠杆菌O157、O26、O45、O103、O111、O121和O145。这些菌株可引发一系列严重症状,如腹泻、出血性结肠炎,甚至溶血性尿毒症综合征(HUS),后者可能导致肾功能衰竭和神经系统并发症,对公共健康构成重大威胁。
疫苗现状的挑战:目前,尚无许可的疫苗能够提供针对多种STEC感染的有效保护。已开发的疫苗,如Epitopix SRP和Econiche,主要针对牛O157大肠杆菌感染,且缺乏对非O157血清型的交叉保护,这限制了其在更广泛范围内的应用。
外膜囊泡(OMV)的潜力:OMV是革兰氏阴性细菌外膜释放的球形纳米级结构,含有多种免疫原性抗原,如脂多糖(LPS)、脂蛋白和肽聚糖。由于其天然的免疫原性和良好的生物相容性,OMV被视为下一代疫苗的理想载体。

本研究旨在构建工程改造的鼠伤寒沙门氏菌,快速产生低内毒素活性的外膜囊泡(OMV),用于递送大肠杆菌的 O 抗原。同时评估展示混合 O 抗原的 OMV 的免疫原性,以及其对抗多种野生型 STEC 感染小鼠的能力,为开发新型、广谱的 STEC 疫苗提供实验依据。

研究人员使用等位基因交换方法,依次在SW121(ΔrfbPΔfliCΔfljB)基因组中引入ΔpagP81、ΔpagP81::PlpplpxE、ΔtolR和Δasd突变,生成工程化鼠伤寒沙门氏菌菌株。同时,构建了携带大肠杆菌O111、O157、O26、O45、O145和O103 O抗原生物合成基因的质粒,并导入到工程化鼠伤寒沙门氏菌中,以实现O抗原的表达。
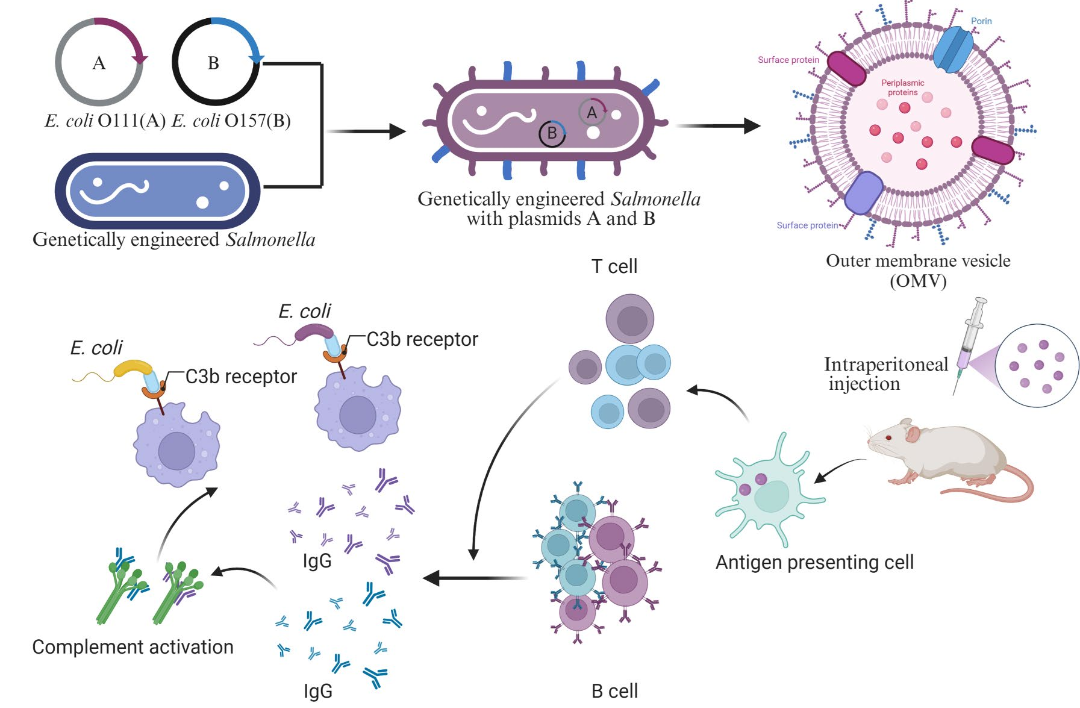
图1. 鼠伤寒沙门氏菌衍生的OMV显示混合异源O抗原示意图

OMV的生产和纯化
工程化沙门氏菌在LB培养基中培养,通过超速离心和密度梯度离心等方法分离和纯化OMV,以获得高纯度的OMV样品。

免疫接种:小鼠通过腹腔注射接受含1µg OMV的PBS溶液,作为阴性对照组则给予不含载体的沙门氏菌衍生的OMV。
免疫原性评估:在初次免疫后第14天、第35天、第49天和/或第120天采集血样,通过ELISA测定血清中大肠杆菌LPS特异性IgG和IgA抗体的浓度,以评估OMV的免疫原性。
生存试验:在初次免疫后第8周,通过腹腔注射挑战评估免疫小鼠的保护率,以验证OMV疫苗的保护效果。
粪便细菌负荷:研究口服途径感染大肠杆菌后,免疫小鼠粪便中野生型大肠杆菌O111和O157的水平,以进一步评估疫苗的保护作用。

流式细胞术应用
补体沉积试验:初次接种后第 49 天采集同一组雌性小鼠血清样本,混合并在 56°C 下灭活 30 分钟。将野生型大肠杆菌 O111 或 O157 菌株与热灭活混合血清混合,孵育后用 PBS 洗涤,再暴露于含有幼兔补体的 PBS 溶液中孵育。处理过的细菌用 FITC 偶联的山羊抗兔补体多克隆抗体处理,最后使用流式细胞仪检测分析 C3 补体沉积情况,评估抗体介导的补体激活能力。

工程化OMV疫苗能产生功能性血清抗体:通过层浪流式细胞仪(FongCyte™)检测FITC荧光信号,发现实验组接种工程化OMV疫苗的小鼠混合血清在相应的E. coli菌株上介导了相似水平的C3沉积( 图2A和B),这表明免疫小鼠产生的抗体能够有效地识别并结合到细菌表面,进而激活补体系统。
载体安全性验证:相反,OMV载体组未检测到细菌上的C3沉积(图2A和B)。这说明OMV载体本身不会引发非特异性的补体激活,从而验证了疫苗载体的安全性。
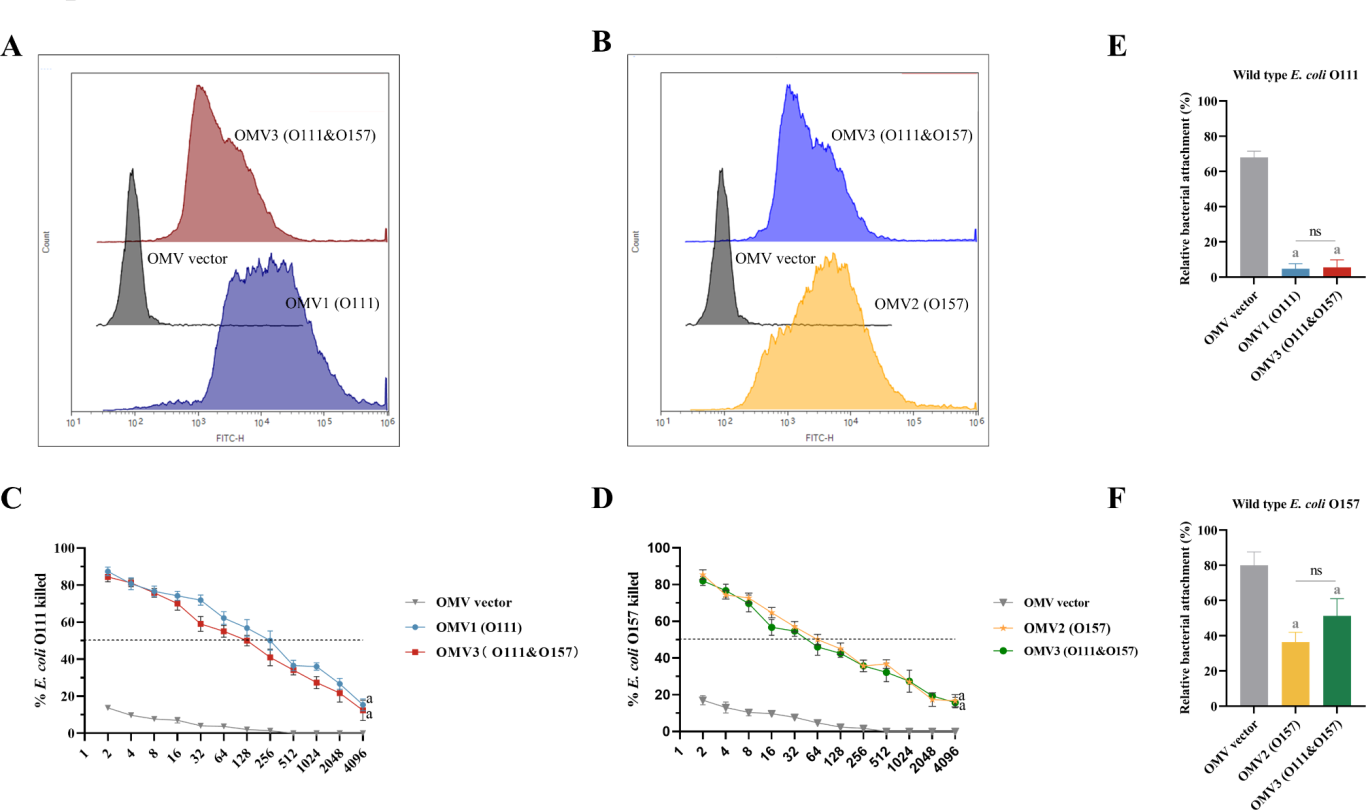
图2 血清抗体体外生物功能检测

层浪流式细胞仪FongCyte™
意义
这些结果表明,工程化鼠伤寒沙门氏菌 OMV 诱导的针对大肠杆菌 O111 和 / 或 O157 O 抗原的特异性血清抗体具有显著生物学功能。它们不仅能特异性结合到细菌表面,还能有效介导补体沉积,这是宿主免疫系统抵御病原体和调节免疫反应的重要过程。此外,流式细胞术结果支持了 OMV 作为疫苗载体的潜力。由于 OMV 能诱导产生具有补体沉积能力的功能性抗体,有望成为开发新型、广谱疫苗的有效工具。
疫苗开发的新策略:本研究开发的STmOMV能够展示混合异源O抗原,为预防多种STEC感染提供了一种创新且改进的策略。与传统的单一抗原疫苗相比,这种混合O抗原的OMV疫苗具有更广谱的保护作用。
免疫原性评估的新方法:传统的疫苗评估方法多聚焦于抗体水平的检测,而本研究则通过流式细胞术等技术手段,进一步评估了抗体的功能活性,为疫苗研发提供了更全面的评估指标。
多价疫苗的潜力:研究显示,三种混合的 STmOMV 经腹腔注射小鼠后,可对六种大肠杆菌感染产生有效保护,表明 OMV 中混合多糖或为多价疫苗,能覆盖常见大肠杆菌血清型,该开发策略既扩大疫苗保护范围,又有助于减少接种次数与成本,具重要公共卫生意义。
安全性与免疫原性的平衡:OMV 作为疫苗载体实现二者有效平衡,本研究表明其本身不引发非特异性免疫反应或毒性作用,保障安全性,同时能有效递送抗原并诱导强烈免疫反应,确保免疫原性,为未来疫苗开发提供新思路
参考文献:
Bian, X., Chen, Y., Zhang, W. et al. Salmonella Typhimurium derived OMV nanoparticle displaying mixed heterologous O-antigens confers immunogenicity and protection against STEC infections in mice. Microb Cell Fact 24, 8 (2025). https://doi.org/10.1186/s12934-024-02640-6