服务中心
CUSTOMER SERVICE
细胞外囊泡(Extracellular Vesicles, EVs)是由细胞主动或被动释放的膜性小泡,广泛参与细胞间通讯、生理调控和疾病进程。根据其生物发生机制、大小和内容物差异,EVs主要分为三类:外泌体(Exosomes)、微囊泡(Microvesicles, MVs)和凋亡小体(Apoptotic Bodies)。以下是系统总结:
EVs的分类与特征 | |||
类型 | 外泌体 (Exosomes) | 微囊泡 (MVs) | 凋亡小体 (Apoptotic Bodies) |
来源 | 多泡体(MVBs)内体途径 | 细胞膜直接出芽 | 凋亡细胞膜断裂 |
大小 | 30–150 nm | 100–1000 nm | 500–2000 nm |
释放机制 | 主动(ESCRT依赖) | 主动(钙离子/细胞骨架依赖) | 被动(凋亡终末阶段) |
标志物 | CD9/CD63/CD81/TSG101 | 整合素、ARF6、选择素 | 磷脂酰丝氨酸、组蛋白、DNA片段 |
内容物 | 核酸(miRNA、lncRNA)、信号蛋白 | 细胞质蛋白、mRNA、脂质 | 细胞器碎片、核物质 |
功能 | 精细细胞通讯、免疫调节 | 病理信号传递(如肿瘤转移) | 凋亡残骸清除 |
外泌体作为细胞间通讯的重要媒介,携带蛋白质、脂质、核酸(如mRNA、miRNA、DNA)等生物活性分子,参与多种生理和病理过程,能够动态实时地反映母细胞的生理病理状态,这些直径仅 30-150 nm 的“细胞间通信大师”,正凭借其在疾病诊断、药物递送等领域的潜力,成为生命科学和医学领域的研究热点。
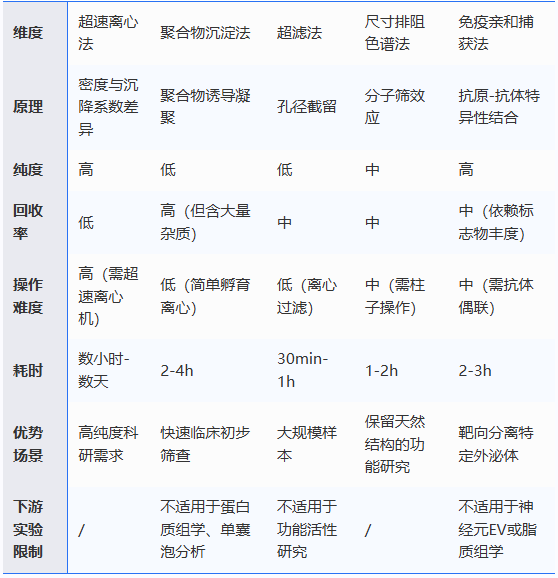
目前,外泌体应用的第一步是分离和纯化,不管是从血液、唾液等体液还是细胞培养上清中获取外泌体,都需要对其进行分离纯化,以去除不需要的杂质。基于外泌体的尺寸、密度、电荷、组成,已经开发出了诸多分离方法,比如超速离心、超滤、尺寸排阻色谱、聚合物沉淀、免疫亲和等,这些传统的分离方法已经非常成熟,尤其是超速离心,被誉为外泌体分离的金标准,为广大研究者所接受。实验室和临床中常用的分离方法多达十余种,从经典的超速离心到前沿的微流控技术,每种方法都有其独特的特点。此文介绍主流方法的优缺点和应用场景,助你快速找到最适合的分离策略。
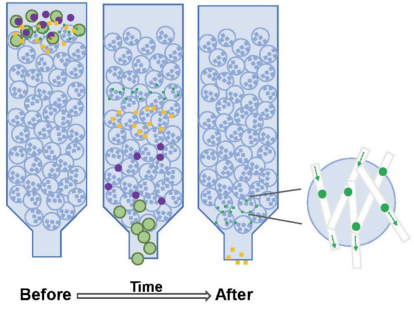
原理:利用不同大小颗粒在离心力下的沉降速度差异分离外泌体。
操作:通过多步离心(如500g→2000g→10,000g→100,000g)逐步去除细胞、碎片、大囊泡,最终沉淀外泌体。也可结合蔗糖密度梯度(如12–36%碘克沙醇)可提高纯度,分离不同密度囊泡(如EVs与非囊泡颗粒)。
优点:技术成熟,是分离外泌体的“金标准”,适用于多种生物样本(细胞培养基、血浆等);纯度高。
缺点:耗时(需数小时至数天);设备成本高(需超速离心机);易受操作影响,低回收率,可能导致外泌体损伤。
应用场景:适用于基础研究中高纯度外泌体分离。
超速离心法
原理:通过多孔介质按颗粒大小分离,小分子滞留,外泌体(40–150 nm)先被洗脱。
操作:样本通过预装柱(如qEV柱),收集特定洗脱组分。
优点:避免高速离心损伤外泌体,保留生物活性;可分离较高纯度外泌体,减少蛋白污染。
缺点:不适合大容量样本,需专用色谱柱;可能与血清蛋白共洗脱,需后续浓缩步骤。
尺寸排阻色谱法
原理:通过孔径滤膜截留外泌体,去除小分子污染物。
操作:通过离心力使样本通过滤膜,收集截流液。
优点:操作简单快速,无需特殊设备;低速离心驱动下能够保证外泌体膜的完整性。
缺点:产量低,大分子污染物(如脂蛋白)可能共截留,有膜堵塞的风险。
应用场景:大体积原料样本纯化,常与其他方法联用(如超速离心)。
原理:利用聚合物(如PEG)降低外泌体溶解度,使其沉淀。
优点:操作简单,时间短;可用于处理小体积样本。
缺点:易共沉淀蛋白质、脂蛋白等杂质,纯度低;聚合物残留可能干扰下游分析。
应用场景:初步富集外泌体,适用于临床样本快速处理。
原理:利用抗体(如抗CD63、CD9)或配体(如Tim-4蛋白)特异性结合外泌体表面标志物,通过磁珠或层析柱分离。
操作:磁珠偶联抗体,与样本孵育后磁分离收集外泌体。
优点:高特异性,可分离特定亚群外泌体(如肿瘤来源外泌体)。
缺点:依赖抗体特异性,成本高,通量低;可能遗漏无相应标志物的外泌体亚群。
应用场景:靶向分离特定细胞来源的外泌体。
免疫亲和捕获法
原理:利用微通道内流体力学特性,按尺寸、电荷分离外泌体。
优点:高精度、高通量,可实现单颗粒分析。
缺点:设备复杂,需定制化芯片,成本高。
微流控法
外泌体分离方法的选择需综合考虑研究目的、样本类型及设备条件。传统超速离心法仍是高纯度分离的金标准,而新兴技术(如微流控)在精准分析中展现潜力。未来趋势倾向于多方法联用(如超速离心 + 免疫捕获)以兼顾效率与特异性,同时标准化操作流程(如 MISEV 指南)将推动跨研究数据可比性。无论你是实验室新手还是临床研究者,选对分离方法,就能让外泌体研究事半功倍!
由于文章篇幅及侧重点问题,详细对比数据并未展示,大家如有需要可自行翻阅下方参考文献~
参考文献
1、Zhang Z, Yu K, You Y, Jiang P, Wu Z, DeTure MA, Dickson DW, Ikezu S, Peng J, Ikezu T. Comprehensive characterization of human brain-derived extracellular vesicles using multiple isolation methods: Implications for diagnostic and therapeutic applications. J Extracell Vesicles. 2023 Aug;12(8):e12358. doi: 10.1002/jev2.12358. PMID: 37563857; PMCID: PMC10415636.
2、Tian Y, Gong M, Hu Y, Liu H, Zhang W, Zhang M, Hu X, Aubert D, Zhu S, Wu L, Yan X. Quality and efficiency assessment of six extracellular vesicle isolation methods by nano-flow cytometry. J Extracell Vesicles. 2019 Nov 29;9(1):1697028. doi: 10.1080/20013078.2019.1697028. PMID: 31839906; PMCID: PMC6896440.
3、李帅,刘亚婷,仰大勇.外泌体分离技术研究进展[J].化学学报,2025,83(04):428-438.
关于层浪
层浪聚焦流式细胞领域,致力于实现流式技术系统化、自动化、智能化,在临床领域推动流式技术的常规化,在科研领域推进国产流式高端化。目前已推出多款流式产品:2激光8色流式细胞仪于2021年初成功获得NMPA注册证;科研型产品3激光14色流式细胞仪FongCyte™上市一年,仪器性能获得客户的高度认可;临床型产品3激光14色流式细胞仪LongCyte®26种型号均获CE认证;4激光流式细胞仪FongCyte™ S和全光谱流式细胞仪CytoStellar™也于2024年陆续发布,吸引了流式技术领域的广泛关注。公司核心团队均在流式技术领域有10余年经验,十年如一日专注流式技术研究,致力于研发生产稳定、可靠、性能优异的产品。层浪未来将陆续推出更多流式产品,为中国的流式技术发展尽绵薄之力,做行业中流式技术普及者,做客户信赖的流式伙伴,为中国的临床和科研事业助飞。